-
1-Info Méthanol
Page en construction
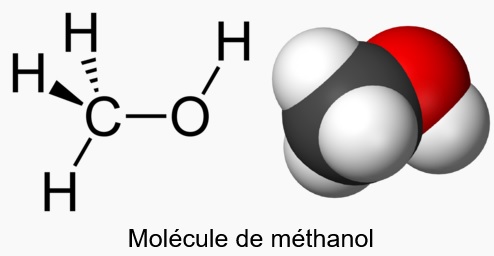
Méthanol ou alcool méthylique
Le méthanol est un composé organique de formule CH₃OH. C’est le plus simple des alcools. Il se présente sous la forme d'un liquide léger, volatil, incolore, toxique, ayant une odeur caractéristique, plus douce et sucrée que celle de l’éthanol. Facilement inflammable (point d'éclair : 12°C en coupelle fermée), ses vapeurs peuvent former des mélanges explosifs avec l'air (dans les limites de 6,7 à 36,5 % en volume). Les solutions aqueuses peuvent aussi s'enflammer aisément.
Source principale et suite Wikipédia
Voir aussi Fiche complète pour Alcool méthylique (CNESST)
Sources du méthanol
Végétaux
Les végétaux en croissance produisent de petites quantités de méthanol, qui varient selon les plantes, la saison et les conditions de croissance.
Des travaux de 2008 laissent penser que les estimations précédentes, de même que le lien entre le taux de méthanol dans l'air et la densité de végétaux ont été jusque là surestimées, tant pour les zones tempérées (d'après les mesures faites en Amérique du Nord) que sous les tropiques (d'après d'autres études in situ). Les auteurs de l'étude invitent à faire des mesures plus détaillées et à définir les facteurs qui influencent la production de méthanol (ex. : type fonctionnel du végétal, saison, santé/stress de la plante) afin de mieux comprendre le cycle du méthanol dans la biosphère.
Un des constats est qu'en Amérique du Nord le taux de méthanol dans l'air se montre en été très corrélé à celui du monoxyde de carbone (CO) dans la couche limite, malgré l'absence d'une source importante de méthanol anthropique. La modélisation reproduit les corrélations et les pentes observées en Amérique du Nord compte tenu des contraintes indépendantes des émissions de CO (Hudman et al. 2008), ce qui conforte l'idée que les sources biogéniques terrestres sont faibles.
En 2008, la source mondiale de méthanol a été réévaluée à 242 Tg/an (dont 85 Tg/an pour la biosphère marine, soit près de trois fois inférieure aux sources terrestres), 103 Tg/an seraient issus de la croissance et de la désintégration des plantes terrestres, 37 Tg/an de la chimie atmosphérique, pendant que 12 Tg/an seraient issus de la combustion de biomasse et de biocarburants, pour seulement 5 Tg/an de sources urbaines et industrielles.
Toujours selon les données de 2008, la durée de vie dans l'atmosphère du méthanol serait d'environ cinq jours (deux fois moindre que ce qui avait été précédemment estimé). L'océan est le meilleur puits de méthanol de l'air : 42% du méthanol de l'atmosphère y disparaît. En complément, l'oxydation en phase gazeuse (par l'ion OH) en dégrade 36%. 17% sont retrouvés au sol sous forme de dépôts secs et 5% sous forme de dépôts humides.
Métabolisme animal
Le méthanol est naturellement présent dans les organismes animaux (humain compris), dans les plantes et donc dans les aliments.
Il est également produit par fermentation et dégradation de composés organiques (feuille) ainsi qu'à travers les métabolismes animaux.
La principale source de méthanol pour l'homme est son alimentation, lors de la consommation de fruits et légumes frais, de jus de fruit, de boissons fermentées et d'aliments allégés contenant de l'aspartame.
Concentration en méthanol dans les aliments
Aliment
Concentration en méthanol
6–27 mg l−1
96–321 mg l−1
10–220 mg l−1
10–100 mg l−1
11–80 mg l−1 (moyenne 34 mg l−1)
13–40 mg l−1 (moyenne 27,4 mg l−1)
> 100 mg l−1
De façon générale, le taux de méthanol dans les jus frais augmente au cours du stockage. La variation dépend, dans les jus de fruits1 frais, du type de fruit2 et de l'activité de deux enzymes, la pectinesterase et la pectate lyase.
Dans les jus de légumes, la variation du taux de méthanol est liée à l'activité de l'enzyme pectinesterase, au pH et à l'acidité totale.
1. Jus de fruits, documentation
Jus de fruits... danger ! (DGS) [archive sans vidéo]
Jus de raisin (Vigne & Raisin)
Voir Blender, centrifugeuse, extracteur
2. Un fruit est dit climactérique si sa maturation est dépendante de l'éthylène, et associée avec une augmentation de la respiration cellulaire de ses tissus. Les fruits et légumes climactériques produisent à un moment précis une grande quantité d’éthylène très rapidement ("pic d’éthylène"). Ils continuent de mûrir après récolte.
Vu (et suite) dans Lexique "phyto-bota"
Production et synthèse du méthanol
Voir Wikipédia
Utilisation du méthanol
Le méthanol est utilisé comme combustible et pour dénaturer l'alcool éthylique (ou éthanol) commercial destiné au même usage. Il est aussi utilisé comme solvant dans les vernis-laques, peintures, ciments, encres, antigel, colorants, plastiques et diverses peintures industrielles. Comme combustible dans les chauffe-plats et appareils à fondue. C'est aussi un carburant pour les fusées...
Suite dans Wikipédia
Autre source new.societechimiquedefrance.fr
L’alcool à brûler ou ménager, outre environ 90% d’éthanol, renferme une petite proportion de méthanol (5 à 10 %) alcool toxique même par simple contact, surtout en cas d’usage prolongé ou répété. En revanche, pour la désinfection du mobilier et autres poignées de porte, l’alcool ménager, utilisé avec des gants et en aérant après usage, fait parfaitement l’affaire, de même que les détergents courants.
Vu dans Coronavirus Je fais quoi ?
L'éthanol est parfois "frelaté", par conséquent rendu imbuvable, par l'ajout de méthanol. Le résultat est connu sous le nom d’alcool dénaturé ou "meths" (au Royaume-Uni), qui ne doit pas être confondu avec meth, une abréviation désignant communément la méthamphétamine. L'alcool dénaturé est généralement de l'alcool éthylique auquel est ajouté un dénaturant pour rendre le mélange impropre à la consommation alimentaire. Le processus de transformation est appelé dénaturation, mais il ne s'agit pas d'une dénaturation au sens biochimique du terme.
Le plus grand débouché du méthanol est son utilisation comme matière première pour la synthèse d’autres produits chimiques. Environ 40% du méthanol est converti en formaldéhyde, pour être transformé en produits aussi divers que des matières plastiques, des résines (dont certaines entrent dans la fabrication du contreplaqué), des peintures, des explosifs, etc.
Le méthanol pur a été utilisé dans des courses automobiles open depuis le milieu des années 1960. Contrairement aux feux de pétrole, les feux de méthanol peuvent être éteints avec de l'eau ordinaire (bien que le méthanol soit moins dense que l'eau, les deux substances sont miscibles, et l'ajout d'eau permet d'absorber la chaleur de l'incendie, du fait de la forte quantité de chaleur requise pour vaporiser l'eau). En outre, un incendie à base de méthanol brûle sans fumée, à la différence de l'essence, qui brûle en produisant une épaisse fumée noire. Si un incendie se produit sur la piste, il n'y a pas de dégagement de fumée risquant de diminuer la visibilité des pilotes arrivant à pleine vitesse sur les lieux de l’accident.
Vue aérienne de l’Indianapolis Motor Speedway en 2001
La décision de passer au méthanol en permanence dans la course américaine de l’IndyCar (American Car Championship) a été une conséquence du crash et de l'explosion dévastatrice à la course d’Indianapolis 500 du 30 mai 1964, qui a provoqué la mort des pilotes américains Eddie Sachs et Dave MacDonald.
Le méthyltertiobutyléther, utilisé depuis les années 1990 à la place du plomb tétraéthyle comme additif antidétonant dans les essences, consomme 19% du méthanol produit, suivi de l’acide acétique (10%). Le méthanol (ou plus rarement l’éthanol) est également utilisé comme composant dans la transestérification des triglycérides pour produire une forme de biodiesel.
Voir aussi Kérosène (Lexique "phyto-médical")
Une unité de production fonctionne en Nouvelle-Zélande depuis les années 1980 et la seconde génération est opérationnelle en Chine. Le méthanol pourrait également, à terme, remplir la même fonction que le naphte ou l’éthane (Cf. Éthylène) dans des procédés actuels de l’industrie pétrochimique. Une unité pilote conçue par Total Petrochemicals pour évaluer la faisabilité technique et économique d’une une voie alternative de production d’oléfines, transformées ensuite en polymères, est opérationnelle depuis 2008.
Elle intègre les procédés de conversion de méthanol en oléfines (MTO), mis au point par UOP/Hydro, et celui de craquage des oléfines (Olefin-Cracking Process, OCP), développé conjointement par Total et UOP. Pour aller plus loin, le recyclage du dioxyde de carbone en excès dans l’atmosphère par hydrogénation en méthanol (Cf. Dioxyde de carbone) et, à travers lui, en carburants et oléfines est largement étudié. Cette nouvelle approche, appelée "économie du méthanol" vise le stockage de l’énergie et la diversification des sources de grands intermédiaires, mais pose le problème d’une source économique de dihydrogène.
Source new.societechimiquedefrance.fr – Voir aussi Wikipédia
Cette société recycle le CO2 en méthanol (Révolution-énergétique 07/10/2023) [archive]
Santé et sécurité
Le méthanol est toxique par deux mécanismes
Premièrement, le méthanol (s’il pénètre dans l’organisme par ingestion, inhalation, absorption cutanée) peut provoquer la mort en raison de ses propriétés de dépresseur du système nerveux central de la même façon que l’éthanol.
Deuxièmement, il devient toxique après avoir été métabolisé dans le foie sous l’action d’une enzyme, l’alcool déshydrogénase qui le transforme en formaldéhyde. Celui-ci est ensuite métabolisé en acide formique par une aldéhyde déshydrogénase ou une formaldéhyde déshydrogénase. Ces composés sont à l'origine d'acidose métabolique, de cécité par destruction du nerf optique, etc.
Les tissus fœtaux sont très sensibles aux effets du méthanol. La dose dangereuse est rapidement atteinte si une personne est régulièrement exposée à des vapeurs ou manipule des liquides sans protection cutanée. La dose mortelle communément admise est de 100 à 125 mL.
Les effets toxiques apparaissent au bout de plusieurs heures
Les premiers symptômes de l'intoxication par le méthanol sont les signes de dépression du système nerveux central : maux de tête, étourdissements, nausées, troubles de coordination, confusion, somnolence, et aux doses élevées, le coma et la mort. Les premières manifestations de l'exposition au méthanol sont en général moins graves que les symptômes résultant de l'ingestion d'une quantité analogue d’alcool éthylique.
Lorsque les premiers symptômes ont disparu, de nouveaux symptômes apparaissent dix à trente heures après la première exposition au méthanol : diminution ou perte complète de la vision, accompagnée d’une acidose1. Ces symptômes sont provoqués par l'accumulation de formiate atteignant des niveaux toxiques dans le sang, et peuvent conduire à la mort par insuffisance respiratoire. Les esters dérivés du méthanol ne jouent aucun rôle dans cet effet toxique.
Le méthanol étant un produit très toxique, toute personne qui a ingéré du méthanol doit être emmenée d’urgence à l’hôpital ou un médecin doit être contacté immédiatement.
Voir Info URGENCES
Des antidotes efficaces peuvent souvent éviter la survenue de dommages irréversibles. Le traitement utilise l’éthanol ou le fomépizole. Ces deux médicaments ont pour effet de ralentir l'action de l’alcool déshydrogénase sur le méthanol par le mécanisme de l’inhibition compétitive, pour qu'il soit excrété par le rein, plutôt que transformé en métabolites toxiques.
Note
1. L’acidose est un trouble de l'équilibre acido-basique désignant un état pathologique dû à une baisse du pH du sang qui devient inférieur à la normale et donc acide (par opposition à l'alcalose). Trop de CO2 et manque de O2 - c'est l'acidose, avec trop d'acides et pas assez de bases. Peut aller jusqu'à l'asphyxie.
Pollution
Les considérations sur l'ajout de méthanol aux carburants auto ont été mises en lumière par l’impact récemment constaté sur les eaux souterraines d'un additif du carburant, le méthyl tert-butyl éther (MTBE). Un défaut d’étanchéité des réservoirs souterrains de stockage d'essence a provoqué des fuites de MTBE, provoquant la contamination des nappes phréatiques. La solubilité élevée du méthanol dans l'eau suscite des préoccupations analogues à propos de l’éventuelle contamination de l'eau qui pourrait découler de l'utilisation généralisée du méthanol comme carburant automobile.
Voir Liens pollueurs
Précautions
La consommation du très toxique méthanol peut entraîner la cécité voire la mort. De l'alcool frelaté est parfois fabriqué avec du méthanol : le buveur est moins sujet à l'ébriété (qu'avec de l'éthanol) mais le nerf optique est atteint et l'individu est exposé à un risque certain de cécité.
Avant toute utilisation régulière, consulter la fiche toxicologique de l'INRS1.
Voir Gueule de bois (Lexique "phyto-médical")
Radiolyse
La radiolyse du méthanol en présence d'une radioactivité2 intense présente certaines similitudes avec celle de l'eau3.
Notes
1. PDF "Base de données FICHES TOXICOLOGIQUES" (INRS) [archive]
2. Voir Nucléaire
3. C. et J.-P. Jay-Gerin, Quelques aspects actuels de la radiolyse du méthanol liquide : Une revue, Radiation Physics and Chemistry, vol.48, n°4, octobre 1996, pp 473-480 (DOI 10.1016/0969-806X(96)00007-2) Radiation chemistry (résumé [archive] en français / anglais)
_______________
Documentation
Histoire au méthanol
Source Wikipédia
Dans leur procédé d’embaumement, les anciens Égyptiens utilisent un grand nombre de substances, y compris le méthanol, obtenu par pyrolyse du bois. Cependant, le méthanol pur n’a été isolé pour la 1ère fois qu’en 1661 par Robert Boyle, qui lui donne le nom d’esprit de bois, parce qu'il est produit par la distillation, ou pyrolyse du bois1a. Il est connu plus tard sous le nom d’esprit de pyrolyse.
En 1834 Jean-Baptiste Dumas et Eugène-Melchior Péligot1b, des chimistes français, déterminent sa composition élémentaire. Ils introduisent aussi le mot méthylène en chimie organique, formé à partir des mots grecs methy = vin + hŷlē = bois (écorce d'arbres). À l’origine, il signifie "alcool fabriqué à partir du bois", mais une erreur a été commise dans l’utilisation du grec.
Le terme dérivé "méthyle" apparaît aux environs de 1840 par abréviation du mot méthylène, et est ensuite utilisé pour décrire l'"alcool méthylique". Ce terme est ensuite transformé en méthanol en 1892 par la Conférence internationale sur la nomenclature des produits chimiques1c.
En 1923, le chimiste allemand Matthias Pier, travaillant pour BASF, développe un procédé pour convertir un gaz de synthèse (un mélange d’oxydes de carbone — monoxyde et dioxyde — et d’hydrogène) en méthanol. Cette méthode utilise le chromate de zinc comme catalyseur et exige des conditions de pression extrêmes, allant de 30 à 100 MPa (300 à 1 000 atmosphères), et des températures très élevées, de l'ordre de 400 °C. La production moderne du méthanol est rendue plus efficace grâce à l'utilisation de catalyseurs (en général le cuivre) capables d’agir à basse pression.
L'utilisation du méthanol comme carburant suscite beaucoup d’intérêt pendant les crises pétrolières des années 1970, en raison de sa disponibilité et de son faible coût. Les problèmes surviennent très rapidement dans l'élaboration des mélanges essence-méthanol. En raison de son faible prix, certains commercialisent du carburant contenant trop de méthanol. D'autres utilisent des techniques de manipulation et de mélange inappropriées.
En 2006 des astronomes utilisant le radio télescope MERLIN de l’Observatoire Jodrell Bank découvrent dans l'espace un nuage de méthanol d'un diamètre de cinq cents milliards de kilomètres, soit environ 25 fois le diamètre du Système solaire (20 milliards de kilomètres). En 2017, du méthanol est détecté dans le nuage de Magellan, c'est-à-dire en dehors de la Voie lactée.
Notes
1a. La pyrolyse du bois, quelquefois appelée distillation, distillation sèche, distillation destructive ou carbonisation, consiste à chauffer fortement le bois sans apport d'oxygène afin d'y entretenir une combustion lente. Elle permet d'obtenir un résidu solide, le charbon de bois, ainsi que différentes fractions qui se condensant forment de l'acide pyroligneux, lequel se sépare par décantation en une couche aqueuse supérieure, le jus pyroligneux et une couche inférieure, les goudrons.
Combustion vive avec flammes et combustion lente avec braises incandescentes.
Source et suite dans Wikipédia
1b. Voir Jean-Baptiste Dumas et Eugène-Melchior Péligot, dans Mediachimie – article original sur Gallica
Voir aussi Paul Karrer "Traité de chimie organique" Éditions du Griffon, 1948, p.85
1c. Le suffixe —yl, qui est utilisé en chimie organique pour former les noms des radicaux, est dérivé du mot "méthyle". Le suffixe —yl indique que la chaine carbonée est un radical qui est ajouté sur une autre chaine carbonée. Les alkyles sont nommés à partir de l'alcane correspondant, le suffixe —ane étant remplacé par le suffixe —yle (ou —yl si l'alkyle n'est pas en dernière position dans le nom du composé, comme dans "méthylbenzène").
Nomenclature en chimie organique, voir
Unine.ch (PDF)
Du Corps à l'Esprit


































 236 visiteur(s) et
236 visiteur(s) et